Камни и минералы и самоцветные камни мира
Фосфаты: Псевдомалахит (Тагилит)
Диагностическая карта.
Cu5 (PO4)2 * H2O
Сингония моноклинная
Твердость
4-5
Удельный вес
3,8-4,4
Спайность
плохая
Излом
раковистый
Цвет
зеленый
Цвет
в порошке
лазурно-зеленый
Блеск
стеклянный

Встречается в виде соскообразных масс лучисто-волокнистого или концентрического полосчатого строения, малахитово-зеленого и черно-зеленого цвета. Растворяется в кислотах. Имеет внешнее сходство с малахитом. Называется также тагилит.
Химический состав - содержание (в %): CuО - 66-72; P2O5 - 20-24; H2O- 6,8 – 9,1. Призматический вид симметрии. Спайность - по {010} ясная. Агрегаты - Отдельные кристаллы редки. Призматический по [001], обычно с неровными гранями и малых размеров. Кристаллы часто соединены в субпараллельные агрегаты с друзовой поверхностью или в полусферы; также почковидный, гроздевидный или массивный с радиально-волокнистой структурой и концентрической полосчатостью; волокна удлиненные вдоль [010]; листоватый; микрокристаллический или плотный; колломорфный.
Происхождение.
Распространен как вторичный минерал, образующийся в зонах окисления месторождений меди в ассоциации с малахитом, хризоколлой, теноритом, пироморфитом.
Псевдомалахит Cu5 (PO4)2 * H2O (содержит фосфор и воду, фосфат) отличается от малахита - Cu2 (CO3) * (OH)2 химической формулой (карбонат). Сам по себе малахит не слишком твердый, хрупкий, при ударе распадается на куски, реагирует на соляную кислоту с бурным вскипанием - вторичный минерал, образующийся в зоне приповерхностного окисления меднорудных месторождений. Псевдомалахит (его называют также "Собака Баскервиллей" или "беларус") - результат активной вулканической деятельности в зоне термальной водяной вулканической кальдеры (источник горячей термальной воды, пар) и содержит фосфор. Болота.
Месторождения.
Обнаружен в Ликаси в провинции Шаба (Заир), в Тюрингии (Германия), на полуострове Корнуолл (Англия), во Франции, Бельгии, штате Пенсильвания (США) и Австралии. Псевдомалахит - вторичный минерал. Встречается вместе с кварцем, халцедоном, малахитом, купритом, хризоколлой, теноритом, лимонитом. Месторождения: Германия (Рейнланд, горы Тюрингенский Лес около Хофа и др.), Англия (Корнуолл), Португалия, а также большие количества в России (Нижний Тагил, откуда второе название минерала - тагилит).


Псевдомалахит. Меднорудянское м-ние, Ниж. Тагил, Ср.Урал, СНГ. Фото: © А.А. Евсеев.

Псевдомалахит ("элит") - синевато-зеленый прожилок в малахите (полосой в центре).
Меднорудянский р-к, Ниж. Тагил, Ср. Урал, Россия, СНГ. Фото: © А.А. Евсеев.
Вокруг голубоватого псевдомалахита - остеклованный зеленый малахит типа кимберлитового
тектита, результат вхождения в литосферные слои и породы земной коры раскаленного уранового
метеоритного болида и формирования сквозной кимберлитовой трубки в земле, пробой до магмы.
Землетрясение, убегают крысы, прячутся домашние животные, мор (болезни и смерти), "Апокалипсис"
Малахит Cu2 (CO3) * (OH)2
Псевдомалахит Cu5 (PO4)2 * H2O
Сведем формулы по одинаковому количеству атомов меди:
Малахит 5 х (Cu2 (CO3) * (OH)2
Псевдомалахит 2 х (Cu5 (PO4)2 * (H2O)
Разберем формулы по количеству атомов:
Малахит Cu10 (C5 O15) * O10 H10
Псевдомалахит Cu10 (P4 O16) * H4 O2
Малахит Cu10 C5 O25 * H10
Псевдомалахит Cu10 P4 O18 * H4 - добавили фосфор P
Разница атомов - C5 O7 * H6 = 3 х (H2O) + 5 х C + O4 (*)
- углерод (алмаз) = 3 х (H2O) + 2 х (CO2) + C3 (**)
- углерод (карбонадо) = 3 х (H2O) + 2 х (CO) + (CO2) + C2 (***)
- комбинация атомов ("СО") = 5 х (CO) + O2 + 3 х H2 (****, "газ")
- комбинация атомов ("СО") = 5 х (CO) + 2 х (HO2) + H2 (****, "вода")
(*) Примечание. Не существует долго в присутствии дополнительных химических и физических комбинация атомов кислорода O4 (фулера). Распадается на O4 -> 2 х O2 (атомы кислорода) или свободный атом кислорода и озон, при ударе молнии: O4 -> O (атом уходит вверх на границу атмосферы, озон) + O3 (свободный озон, накапливается у поверхности земли, тяжелый). Углеродные фулеры C5 - шунгит в Карелии (СНГ), лечатся - выходами кислорода (фурелы и др). Лучший кислородный санаторий (Карелия, РФ, СНГ - лечатся на севере Европы, РФ, СНГ, Петр I).
(**) Примечание. Наиболее привлекательная, алмазоносная кимберлитовая трубка ("Большая Яма" Кимберли в ЮАР, "Мир", "Удачная" в РФ, СНГ, "ИнГОК" в Украине, СНГ) - формируется черный свободный газ углерод C, серый жидкий графит C2 (связанный) и белый твердый алмаз C3 или карбонадо (смесь углеродов в кристалле). Химическая активность кимберлитовых трубок - вдыхание углерода С -> СO -> СO2 (удушье, малокровие, отнимает атом кислорода у гемоглобина крови), разъедание графитом (язвы), смерть (алмазификация организма, кристаллы, силикоз). Источники воды типа "Миргород", белая (невозможно напиться - иметь питьевую альтернативу).
(***) Примечание. Ядовитый даже в малых дозах угарный газ СO и углерод С. Отравления (обморок). Отравления углекислым газом CO2 - забор углекислого газа для нужд промышленности (газированная вода, "содовая", "американский синдром", типа "Кисловодск", нарзан, РФ, СНГ).
(****) Примечание. Сочетание атомов C5 * O7 * H6. Угарный газ СO с кислородом и водородом, опасное трудно диагностируемое сочетание. Есть "сухая" и "мокрая" (с водой, пар, кальдера). При выходах сухих вулканических гаджов отбирают кислород и водород (сухие кальдеры). Второй тип - минеральная вода, в горах реки и ручьи, источники (при кипячении выходит водород).
- водород ("бомба") = 5 х (CO) + 2 х (H2O) + H2 (*****)
(*****) Примечание. В связи с ударом радиоактивного урана и т.п. (болид) происходит ядерная и термоядерная реакция и формируется изотоп газа водорода H1 и его редкие изотопы - дейтерий H2 и тритий H3, а также их ядерные и термоядерные производные - жидкий гелий He2 (из дейтерия H2) и литий Li3 (из трития H3). Радиационные поверхностные поражения активным ядерным изотопом водорода H1 (кожа - нейтрон0), термоядерные ожоги He2 (мышцы, мягкие ткани, средняя тяжесть - протон+) и поражения Li3 (обугливание и "углификация" тела, крайне тяжелые поражения и ожоги, "горение тела", смерть, тотальное поражение радиацией - электрон-).
Просуммируем формулы по количеству атомов:
Малахит Cu10 (C5 O15) * O10 H10
Псевдомалахит Cu10 (P4 O16) * H4 O2
Малахит Cu5 (C2 O7) * O5 H5 |
Псевдомалахит Cu10 (P4 O16) * H4 O2 | на фото выше (малахит + псевдомалахит)
Малахит Cu5 (C3 O8) * O5 H5 |
Сумма атомов - Cu20 C5 P4 O43 H14
=> Cu20 + P4 (беларусский тип)
Примечание. Перетирание кимберлита и минералов в зоне активного вращения кимберлитовой трубки (смерч в земле). Формируется самородная медь ("отпечаток солей"), 99,3%, в максимально высоком количестве, восстановление металлической меди (РФ, СНГ) и механический вынос фулер фосфора отдельно, химически активен - болота Беларуси, Европа, СНГ. Кимберлитовая сепарация - быстрое механическое вращение кимберлитовой трубки (торнадо в земле) обеспечивает практически полную сепарацию минералов (РФ, СНГ). Механический разогрев - термальное тепло (огарок).
Химические реакции восстановления меди из солей и отделение фосфора идет в присутствии катализатора азота N, который в химической реакции на финальном процессе не используется и вступает во вторичные химические реакции с оставшимся окружением. Магматический газ N2 (ядерные реакции внутри ядра Земли). Высокое содержание в атомсфере, химически инертный. Дополнительно выделяется цианистый газ - ядовитый, формируются цианиды - ядовитые соединения. Бесцветный ядовитый газ с горьким запахом, состоящий из азота и углерода циан (CN)2. Пример ядовитых сопутствующих соединений сквозной магматической кальдеры - цианистый калий KCN, цианид натрия NaCN (натриевый теплоноситель ядерного реактора АЗС). На основе азота N.
Остаток атомов - -- C5 -- O43 H14 => C5 * O43 * H14 (кимберлит вращения)
Катализатор - N + N2 + Nn (свободный азот, газ, фулеры азота)
Малахит -- (C2 O7) * O5 H5 |
Псевдомалахит -- (-- O16) * H4 O2 | циан (CN)2
Малахит -- (C3 O8) * O5 H5 |
Ядерная реакция U92 (уран) -> N7 (азот) + х85 (85 ед. таблицы Менделеева)
Ядерная реакция U236 (уран) -> N14 (азот) + х222 (222 ед. атомарной массы)
U отнимает 2 атома кислорода O и формирует уранинит UO2, настуран UO2 * n (H2O)
Нестойкий термальный уран U3O8 также опасен, нечем дышать (отнимает кислород)
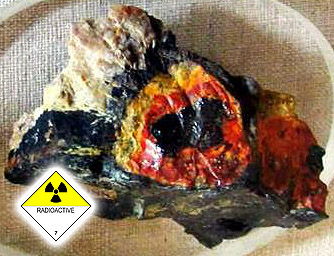 Пример близости кимберлитовой трубки третьего типа - уранинит, гуммит по ураниниту (Северная Карелия, РФ, Европейская часть России, СНГ). Его выбрасывает на поверхность кимберлитовая трубка - наподобие земляного торнадо (смерча, тромба). Месторождения урана - Володарск-Волынские пегматиты, Житомирская обл. запада Украины (СНГ) и Луганская область Украины (СНГ), Крым (СНГ). Экономике посвящен "Капитал" (К. Маркс).
Пример близости кимберлитовой трубки третьего типа - уранинит, гуммит по ураниниту (Северная Карелия, РФ, Европейская часть России, СНГ). Его выбрасывает на поверхность кимберлитовая трубка - наподобие земляного торнадо (смерча, тромба). Месторождения урана - Володарск-Волынские пегматиты, Житомирская обл. запада Украины (СНГ) и Луганская область Украины (СНГ), Крым (СНГ). Экономике посвящен "Капитал" (К. Маркс).
Это - кимберлитовые трубки, в которых идет активнейшая ядерная реакция, причем чем глубже в тело сужающееся наподобие морковки тело кимберлитовой трубки (кимберлита), тем выше радиоактивный фон кимберлита. Страшный выдув газа из тела кимберлитовой трубки (т.н. "лазерный"). "Мир" (Якутия, РФ, СНГ).
На фото - полная псевдоморфоза по разноцветному турмалину эльбаиту (форма). Похоже на эльбаитоподобный дравит-шерл (турмалин), но нужен дозиметр. От 18 миллирентген/час - остановка, от 24 миллирентген/час - краткосрочное пребывание, от 32 миллирентген/час - покинуть. От 100 миллирентген/час - смерть. Знаменитые урановые кимберлитовые рудники и копи. Пример радиоактивного выброса - пос. Новогорный (РФ, СНГ), 1987-1989 г, 2 рентгена/час.
Особенности кимберлитов описанных типов (на примере ураново-малахитово-псевдомалахитового типа с активным выбросом кальдеры) - тяжело дышать, не хватает кислорода для дыхания, отравления углеродом, угарным и углекислым газом, отравления кислородом (чистый, яд) и водородно-азотные проблемы атомсферы. Падение уровня атомсферы над кимберлитом, горстово-сбросовые структуры воронкообразного вращения кимберлита в земле (и яма в космосе, стратосфера), выдув газов из земли до "лазерного" ("лучевого") типа, невидимо. Радиоактивно.
ВОДОРОД, Н (лат. hydrogenium; а. hydrogen; н. Wasserstoff; ф. hydrogene; и. hidrogeno), - химический элемент периодической системы элементов Менделеева, который относят одновременно к I и VII группам, атомный номер 1, атомная масса 1,0079. Природный водород имеет стабильные изотопы - протий или водород (1Н, H1), опасный ядерный дейтерий (2Н, H2 или D) и прославленный радиоактивный теромоядерный - тритий (3Н, H3 или Т). Для природных соединений Земли среднее отношение D/Н = (158±2)*10-6 Равновесное содержание 3Н на Земле ~5*1027 атомов.
Водород впервые описал в 1766 г. ученый Г. Кавендиш. При обычных условиях водород - газ без цвета, запаха и вкуса. В природе в свободном состоянии находится в форме молекул Н2. Энергия диссоциации молекулы Н2 - 4,776 эВ; потенциал ионизации атома водорода 13,595 эВ. Водород - самое легкое вещество из всех известных, плотность при 0oС и 0,1 МПа 0,0899 кг/м3; t кипения- 252,6oС, t плавления - 259,1oС; критические параметры: t - 240oС, давление 1,28 МПа, плотность 31,2 кг/ м3. Наиболее теплопроводный из всех газов - 0,174 Вт/(м*К) при 0oС и 1 МПа, удельная теплоемкость 14,208*103 Дж(кг*К).
Жидкий водород очень легок (плотность при -253oС 70,8 кг/м3) и текуч (вязкость при -253oС равна 13,8 сП). В большинстве соединений водород проявляет степень окисления +1 (подобен щелочным металлам), реже -1 (подобен гидридам металлов). В обычных условиях молекулярный водород малоактивен; растворимость в воде при 20oС и 1 МПа 0,0182 мл/г; хорошо растворим в металлах - Ni, Pt, Pd и др. С кислородом образует воду с выделением тепла 143,3 МДж/кг (при 25oС и 0,1 МПа); при 550oС и выше реакция сопровождается взрывом. При взаимодействии с фтором и хлором реакции идут со взрывом. Основные соединения водорода: вода Н2О, аммиак NH3, сероводород Н2S, метан CH4, гидриды металлов и галогенов CaH2, HBr, HCl, органические соединения С2Н4, HCHO, CH3OH, парафины и др.
Водород - распространенный в природе элемент, содержание его в земной коре 1 % (по массе). Главный резервуар водорода на Земле - вода гидросферы (11,19%, по массе). Водород - один из основных компонентов природных органических соединений. В свободном состоянии присутствует в вулканических и других природных газах, в атмосфере (0,0001%, по числу атомов). Составляет основную часть массы Солнца, звезд, межзвездного газа, газовых туманностей. В атмосферах планет присутствует в форме Н2, CH4, NH3, Н2О, CH, NHOH и др. Входит в состав корпускулярного излучения Солнца (потоки протонов) и космических лучей (потоки электронов).
Сырье для промышленного получения водорода - кимберлиты, газы нефтепереработки, природные газы, продукты газификации угля и др. Основные способы получения водорода: реакция углеводородов с водяным паром, неполное окисление углеводородов кислородом, конверсия окиси углерода, электролиз воды. Водород применяют для производства аммиака, спиртов, синтетического бензина, соляной кислоты, гидроочистки нефтепродуктов, резки металлов водородно-кислородным пламенем. Водород - перспективное газообразное горючее (NASA). Дейтерий и тритий нашли применение в атомной энергетике (АЭС). По материалам: http://www.mining-enc.ru
 ВОДА (а. water; н. Wasser; ф. eau; и. agua) - распространенное в природе простейшее, устойчивое в обычных условиях стойкое химическое соединение водорода с кислородом, Н2О (11,19% водорода и 88,81% кислорода, по массе); бесцветная жидкость (в толстых слоях - голубоватого цвета от водрода, эффект р. Волга, РФ, СНГ, и зеленоватого цвета - море, медь и золото) без запаха и вкуса. Коричневая - битум (р. Дон). Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды. Вода - обязательный компонент практически всех технологических процессов (гидравлика, с 1969 г. - на кимберлитах).
ВОДА (а. water; н. Wasser; ф. eau; и. agua) - распространенное в природе простейшее, устойчивое в обычных условиях стойкое химическое соединение водорода с кислородом, Н2О (11,19% водорода и 88,81% кислорода, по массе); бесцветная жидкость (в толстых слоях - голубоватого цвета от водрода, эффект р. Волга, РФ, СНГ, и зеленоватого цвета - море, медь и золото) без запаха и вкуса. Коричневая - битум (р. Дон). Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды. Вода - обязательный компонент практически всех технологических процессов (гидравлика, с 1969 г. - на кимберлитах).
Изотопный состав воды. В связи с существованием двух стабильных изотопов у водорода 1Н (H1) и 2Н, D (H2), обычно обозначаемых Н и D (дейтерий), и трех у кислорода (16О, 17О и 18О) известно 9 изотопных разновидностей воды. Особый интерес представляет тяжелая вода D2О. Физические свойства воды и их аномалии определяются тем, что ее молекулы объединяются в комплексы водородными связями (кимберлит уранового и ииного типа). Существует ряд гипотетических структурных моделей воды, требующих дальнейшего уточнения.
Структура воды отличается неустойчивостью различного характера, т.к. водородная связь примерно в 10 раз сильнее обычного межмолекулярного взаимодействия (угол между химическими связями 104o27') - возможно присоединение атомов углерода C и формирования спорадических органических соединений. Структура воды зависит от характера и концентрации примесей, присутствующих в ней в ионной, молекулярной и фулерной (объемной, сетчатообразной) формах. Различные ионы, молекулы растворенных газов могут изменять структуру воды, например, мелкие атомы гелия и молекулы водорода могут помещаться в химической структуре воды без нарушения ее водородных и иных связей.
Распределение электронной плотности в молекуле воды таково, что создаются 4 полюса зарядов: 2 положительных, связанных с атомами водорода, и 2 отрицательных, связанных с электронными облаками необобществленных пар электронов атома кислорода. Указанные полюса зарядов располагаются в вершинах тетраэдра. Благодаря этой полярности вода имеет дипольный момент (1,86 D). Кристаллическая структура обычного льда гексагональная, "рыхлая" (водород), в ней много "пустот" (при плотной "упаковке" молекул воды в кристаллах льда его плотность составила около 1600 кг/м3). В жидкой воде присущая льду связь каждой молекулы Н2О с четырьмя соседними ("ближний порядок") в значительной степени сохраняется; однако "рыхлость" структуры при плавлении льда уменьшается, молекулы "дальнего порядка" попадают в "пустоты", что ведет к росту плотности воды.
Многие физические свойства обычной воды (раствор) обнаруживают существенные аномалии. Плотность воды достигает максимального значения 1000 кг/м3 при +3,98oС; при дальнейшем охлаждении она уменьшается, а при замерзании скачкообразно падает (присутствует кимберлитовый водород - катализаторы, формирование дендритов, твердых растворов и рыхлых масс), тогда как у остальных веществ кристаллизация сопровождается увеличением плотности (без примесей).
Вода способна к значительному переохлаждению, т.е. может оставаться в жидком состоянии ниже температуры плавления (даже при -30oС) - дистиллированная, без примесей инородных зародышевых центров кристаллизации. Вязкость воды, с ростом давления уменьшается, а не повышается, как у других жидкостей. Сжимаемость воды крайне невелика и с ростом температуры уменьшается. Некоторые аномалии ослабевают по мере минерализации воды и даже исчезают в насыщенных растворах. Свойства воды могут значительно изменяться в зависимости от естественных условий, существующих в природе, или искусственно создаваемых (действие температуры и давления, магнитных полей).
Химические свойства воды в обычных условиях. Вода - достаточно устойчивое соединение, распад молекул Н2О становится заметным лишь выше 1500oС. Вода взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты. Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов, кетонов. Вода участвует во многих химических процессах как катализатор. Так, взаимодействие щелочных металлов или водорода с галогенами, многие окислительные реакции не идут в отсутствии хотя бы ничтожных количеств воды.
Газы (водород, гелий и другие кимберлитовые компоненты) достаточно хорошо растворяются в воде, если способны вступать с ней в химические взаимодействия (аммиак, сероводород, сернистый газ, двуокись углерода). Прочие газы менее растворимы в воде. При понижении давления и повышении температуры (до 80oС) растворимость газов в воде, уменьшается. Многие газы при низких температурах и повышении давления не только растворяются в воде, но и образуют кристаллогидраты.
Вода - слабый электролит (литий и т.п.), диссоциирующий по уравнению Н2O <=> H+ + OH-, причем количественной характеристикой электролитической диссоциации воды служит ионное произведение воды: Кв = [ Н+][OH-], где [Н+] и [OH-] - концентрация соответствующих ионов в г-ион/л; Кв составляет 10-14 (22oС) и 72 * 10-14 (100єС). Вода растворяет множество кислот, оснований, минеральных солей. Такие растворы проводят электрический ток благодаря диссоциации растворенных веществ с образованием гидратированных ионов.
Многие вещества при растворении в воде вступают с ней в реакцию обменного разложения, называется гидролизом. Из органических веществ в воде растворяются те, которые содержат полярные группы (-OH, -NH2, -COOH и др.) и имеют не слишком большую молекулярную массу. Сама вода хорошо растворима (или смешивается во всех отношениях) в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам вода присутствует практически всегда и способна резко изменять физические константы последних. В природе вода встречается в виде растворов.
Вода в природе. Природная вода является своеобразным минералом, характеризующимся непостоянным химическим составом, наличием разнообразных примесей, изменяющих ее свойства, и служит объектом добычи, переработки и использования в огромных количествах (около 3 * 1012 м3/год). Океаны, моря, озера, водохранилища, реки, подземные воды, почвенная влага образуют водную оболочку (Гидросфера). В атмосфере вода находится в виде пара, тумана и облаков, капель дождя и кристаллов снега.
В криолитозоне пресные и солоноватые подземные гравитационные воды находятся в виде подземного льда, обусловливая существование мерзлых пород. Подземные льды в мерзлых породах (особенно в дисперсных) изменяют их физические свойства (резко повышают механическую прочность, уменьшают водопроницаемость и т.д.). Соленые подземные воды и рассолы в криолитозоне имеют отрицательные температуры и испытывают при их колебаниях изменения в составе.
В земной коре содержится, по разным оценкам, от 1 до 1,3 млрд. км3 воды. При этом запасы пресных (слабоминерализованных) вод достаточно ограничены, а соленые воды - источники минеральных компонентов типа галит (NaCl - поваренная соль) и т.п.. Значительное количество воды в земной коре находится в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезема, гидросиликаты и др.). Обширный комплекс менающих объем камнй и минералов (вода в пустыне и т.п.).
Конституционная (H2O <=> (OH-) + (Н+)) вода находится в кристаллической решетке минералов в виде ионов OH-, реже - Н+, т.е. образуется при механическом и ином (химическом, электрическом - ионном и радиационном) разрушении кристаллической решетки любого минерала. Кристаллизационная вода занимает определенные места в структуре решетки минерала в виде молекул Н2О. Часть кристаллизационной воды, выделяющейся без разрушения решетки и поглощаемой минералом при изменении внешних условий (нагрев-охлаждение), называется цеолитной. Молекулы адсорбционной воды связаны с поверхностью минеральных кристаллов, образуют гигроскопический слой (в минералах слоистой структуры содержатся межплоскостные слои). В значительных количествах адсорбционная вода присутствует в твердых коллоидах (опалы и др.). Вода, заполняющая тонкие канальцы в почве, породе, называется гигроскопической (капиллярной). Различают свободную воду, заполняющую пустоты, трещины и перемещающуюся под действием силы тяжести, нагрева батолитов, механической и радиационной химии кимберлитов и др.
Огромные количества воды (13-15 млрд. км3) сосредоточены в мантии Земли (выброс через магматические кальдеры). Вода, выделявшаяся из мантии в процессе внутреннего разогревания Земли на ранних стадиях ее развития, по современным воззрениям, сформировала гидросферу. Ежегодное поступление воды из мантии и магматических очагов составляет около 1 км3 (Ювенильные воды). Имеются данные о том, что вода, хотя бы частично, имеет космическое происхождение (выбросы Солнца, планет, сверхновых и квазаров): протоны, пришедшие в верхнюю атмосферу от Солнца и других звезд, захватив электроны, превращаются в атомы водорода, которые, соединяясь с атомами кислорода, дают воду. Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой. Вода - активный фактор эндогенных и экзогенных геологических процессов, с водой тесно связаны процессы формирования месторождений и минералообразование.
В природных условиях количественный состав примесей меняется в зависимости от происхождения воды и геологических условий. При концентрации солей до 1 г/кг воду считают пресной, до 25 г/кг - солоноватой, свыше - соленой. Наименее минерализованными водами являются атмосферные осадки (в среднем около 10-20 мг/кг), затем пресные озера и реки (50-1000 мг/кг) - хотя соленые есть. В г. Харьков, Украина, СНГ был летний соленый дождь - 2010 г. (водяные торнадо). Соленость океана колеблется около 35 г/кг; многие моря имеют меньшую минерализацию (Черное море - 17-22 г/кг, приток воды р. Дон, Балтийское море - приток воды р. Нева, 8-16 г/кг, Каспийское море - приток воды р. Волка 11-13 г/кг - по типу Водопад Митчелл, комплексный водопадный кимберлит с патерами).
Минерализация подземных вод вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг; в глубинных артезианских бассейнах минерализация воды колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озерах (до 300 г/кг) и глубокозалегающих подземных водах (до 600 г/кг). В пресных водах преобладают ионы HCO3-, Ca2+ и Mg2+. Содержание в воде ионов Ca2+ и Mg2+ определяет ее жесткость. По мере увеличения общей минерализации растет концентрация ионов SO42-, Cl-, Na+ и К+. В высокоминерализованных водах (г. Миргород, Полтавская обл., Украина, СНГ и др.) преобладают ионы Cl- и Na+, реже Mg2+ и редко Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных минеральных кимберлитовых водах.
Первоисточниками солей природных вод являются вещества, образующиеся при химическом выветривании изверженных пород (Ca2+, Mg2+, Na+, К+ и др.) и выделяющиеся на протяжении всей истории Земли из ее недр (CO2, SO2, HCl, NH3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с водой, зависит состав воды, на изучении которого основаны гидрогеохимические поиски месторождений полезных ископаемых. Большое значение для состава воды имеет и воздействие живых организмов.
Из растворенных газов в природных водах присутствуют азот, кислород, двуокись углерода, инертные газы, сероводород и углеводороды. Газонасыщенность подземных вод изменяется от n * 10 до n * 103 см3/л. Количество растворенного газа прямо пропорционально давлению газа или парциальному давлению в смеси газов. При температуре до 100oС наблюдается обратная зависимость растворимости газов в воде, при температуре выше 100oС прямая. Газонасыщенность воды зависит также от величины минерализации, увеличение которой снижает растворимость газов. Наиболее распространенными газами, растворенными в подземных водах, являются CO2, N2, CH4. Реже и в меньших количествах растворены О2, Н2S, Н2, тяжелые углеводороды, инертные газы и др. Наблюдается зональное распределение газов в подземной гидросфере по вертикали (сверху вниз): О2 N2 N2 Н2S - CO2 - CH4 - N2 CH4 - N2 (или N2 - CH4) CH4 - CO2 - CH4 Н2S - CO2 - CH4 (в порядке преобладания).
Концентрация органических веществ невелика - в среднем в реках около 20 мг/л, в океане около 4 мг/л. Исключение составляют воды болотных и нефтяных месторождений и воды, загрязненные промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих воду, и соединения, образующиеся при распаде из их остатков.
При исследованиях закономерностей формирования и распространения природных вод, оценке возможностей их использования (в питьевых, хозяйственно-технических, промышленных, ирригационных, бальнеологических и др. целях), гидрогеохимических поисках месторождений (нефти, газа, полиметаллов, Br, I, В и т.д.) проводят их анализ. В водах определяют: физические и органолептические свойства (температуру, цвет, вкус, запах, мутность, прозрачность, плотность, электропроводность); содержание растворенных минеральных, органических, радиоактивных веществ, свободных газов; различные показатели (pH, Eh, жесткость, окисляемость, агрессивность и др.); изотопный и микробиологический состав. Вид и методы анализов определяются целью исследований и требуемой точностью. При гидрогеохимических поисках руд определяют микрокомпоненты (Cu, Pb, Sn, Ag, Mo, Be, Rb, Cs, Mn, Zn и др.); при поисках и исследованиях нефти - органические вещества (кислоты, ароматические углеводороды, фенолы и др.), газы, индикаторную микрофлору; при изучении минеральных вод - специфические компоненты (As, Br, I, Fe, органические вещества и др.), газовый состав (CO2, Н2S, Н2, О2, Rn, N2, CH4); при исследованиях для водоснабжения, санитарного контроля воды - загрязняющие и токсические (Pb, As, Se, Sr и др.) вещества, бактериологические показатели; при оценке технической свойств воды - обесцвечиваемость, коагулируемость, коррозийные свойства, фильтруемость.
Воду анализируют методами аналитической химии: титриметрическими и инструментальными (колориметрия, фотометрия пламени, фотоколориметрия, спектрофотометрия, потенциометрия, радиометрия, хроматография и др.). Бактериологические анализы выполняют методами прямого счета на мембранных фильтрах и др. Для обеспечения максимальной сохранности состава воды при анализах разработаны правила отбора, предварительной обработки и консервации (подкисление, хлороформирование, охлаждение и др.) проб. Лимитируются сроки хранения проб воды до анализа. Для анализа воды с малым содержанием компонентов применяют концентрирование, экстракцию и др.
Применение воды. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение. Вода - химический реагент, участвующий в производстве кислорода, водорода, щелочей, кислот, спиртов, альдегидов, гашеной извести и др. Вода используется как технологический компонент для варки, растворения, разбавления, выщелачивания, кристаллизации и т.д. Воду применяют в многочисленных производственных процессах. В технике вода служит энергоносителем (гидроэнергетика), теплоносителем (нагревание, охлаждение), рабочим телом (паровые машины). Природные воды употребляют для питьевого и хозяйственного водоснабжения, теплоснабжения (Термальные воды), в бальнеологии (Минеральные воды), для извлечения из них ценных компонентов (Рассолы) и т.п. При производстве горных работ воду используют для транспортирования горных пород и полезных ископаемых в шахтах и карьерах (Гидравлический транспорт), для передачи давления и мощности при бурении забойными двигателями, а также для промывки скважин и др. При разработке обводненных месторождений полезных ископаемых комплексно решаются вопросы водозащиты горных выработок, водопонижения, водоотлива, барража, дренажа, защиты оборудования от действия агрессивных вод и использования воды (например, для гидравлического разрушения горных пород, гидравлической закладки выработанного пространства, пылеподавления, заиливания, противопожарных мероприятий, заводнения месторождений нефти). С применением воды проводятся обогащение полезных ископаемых, их сортировка и т.п.
Изменение свойств воды (магнитная обработка - удаление магнитами феррометаллических, полуорганических, органических и иных реагирующих на магнитное поле примесей) используется для улучшения процессов флотации, очистки воды от взвесей многих типов и др. В результате промышленного использования воды возникает необходимость введения водооборотных систем, бессточных технологий и очистки воды. При сбрасывании сточных вод в природные водоемы очистка производится до норм предельно допустимых концентраций растворенных веществ и проводятся мероприятия по охране гидросферы, охране подземных вод (см. Очистка вод). В СНГ потребление водных ресурсов регламентируется Основами водного законодательства СНГ и государств содружества. Существуют также международные соглашения по охране водных ресурсов в рамках СЭВ и других межправительственных организаций. По материалам: http://www.mining-enc.ru
Камень, минерал, минералы, камни, кристалл, порода, камни драгоценные, натуральные камни, горные породы, драгоценный камень, горная порода, дикий камень, камни и минералы, название камней, природный камень, натуральный камень, камни минералы, полудрагоценный камень, минералы это камни каталог, минералогия, значение камней, что такое минералы, свойства камней, название камней и минералов, природные камни названия и фото, природные камни, минералы камни, камни натуральные, камни фото и названия, минералы названия, дикий камень фото, горные породы и минералы, минералы и камни, химический состав минералов, из чего состоит камень, самые удивительные камни и минералы, минералы список, каталог минералов, камни и их свойства, драгоценные минералы, камень природный, минералы виды, виды минералов, камень кристалл, камни свойства, геология камни, основные минералы, минералы и их классификация, самые красивые минералы, минералы определение, происхождение камней, кристалл минерал, обычные камни, минералы классификация, камни описание, как выглядят драгоценные камни в природе, камень что это, виды природного камня, ценный минерал, наука о минералах, химическая классификация минералов, магнитные свойства минералов, мир минералов, минерал горная порода, какие есть горные породы и минералы, типы камней, камень состав, описание минералов, камни в природе, полезные камни, определитель камней, плотность минералов, твердость горных пород, картинки камней и их названия, классификация минералов геология, горные породы и минералы, полудрагоценные камни названия и фото, характеристика минералов, структура камня, минералы в природе.
